
今日,希格生科高级科学家杨明明以第一作者身份在机制研究领域国际顶刊Nucleic Acids Research(影响因子:16.97)发表一篇研究成果。该论文题为“KDM6B promotes PARthanatos via suppression of O6-methylguanine DNA methyltransferase repair and sustained checkpoint response”。本文的其他共同作者均来自美国德州大学西南医学中心。
烷基化合物,以造成DNA损伤为基础,是临床上常用的抗癌药物。但部分癌症患者对药物不反应或耐药,因此对抗癌药物的耐药性研究也是亟待解决的问题。本文通过耐药筛选,深度研究了去甲基化H3K27me3的表观遗传调控分子KDM6B,能通过上调DNA修复酶MGMT及持续活化Checkpoints Kinase-1而使肿瘤细胞耐受烷基化合物的攻击,为后续的小分子精准杀伤肿瘤细胞提供理论基础。
论文摘要
Poly (ADP-ribose) polymerase-1 (PARP-1)是一个重要的DNA损伤感知分子,PARP-1既可以促进DNA修复,其抑制剂诸如Olaparib已经在胰腺癌的临床实验中取得非常显著的疗效;另一方面,PARP-1的过度激活又可以引起细胞死亡,该死亡信号通路称为PARthanatos,但影响PARthanatos的因子却知之甚少。本文在建立PARthanatos的细胞模型基础上筛选出了KDM6B,发现KDM6B缺失的细胞对化疗药物是耐药的。
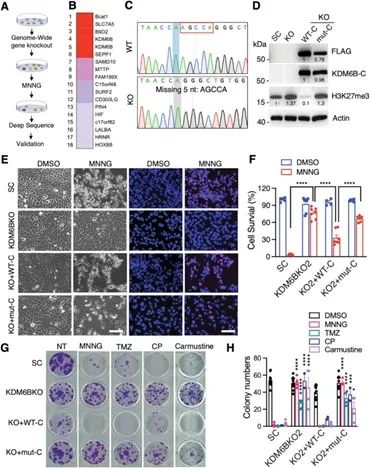
机制研究表明,KDM6B可以调控细胞内的DNA修复酶MGMT的启动子的甲基化水平从而影响其蛋白表达,该调控依赖KDM6B的去甲基化活性。用MGMT的抑制剂可以部分恢复细胞对化疗药物的敏感性。
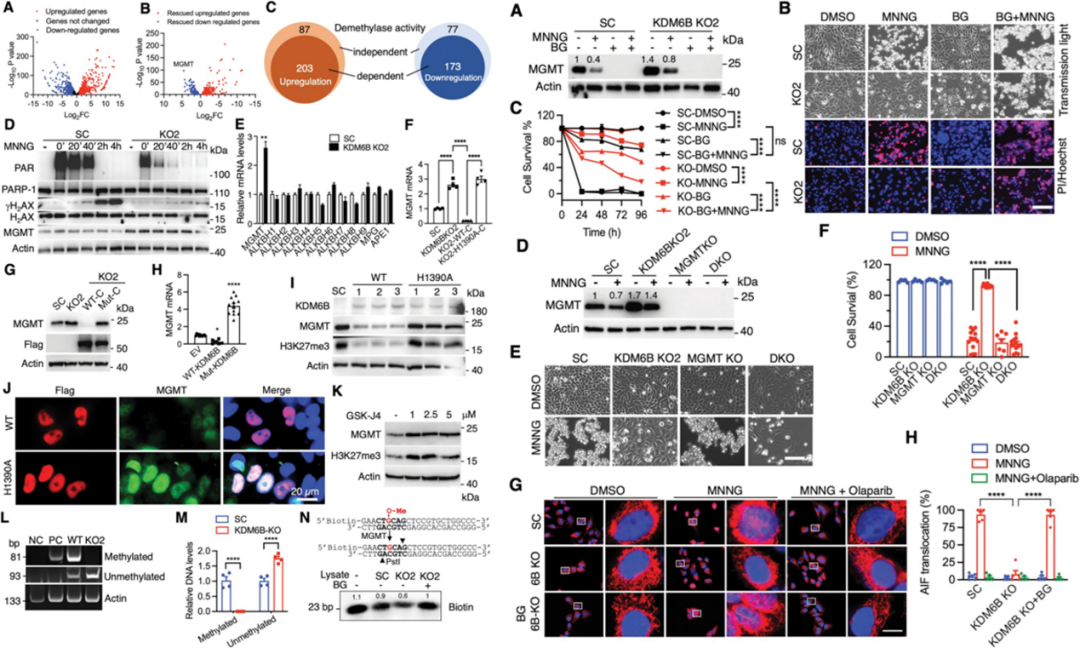
KDM6B调控MGMT,抑制MGMT可以恢复细胞对药物的敏感性
除上调MGMT外,本文作者还发现,缺失KDM6B的细胞存在Checkpoint Kinase-1 (Chk1)持续活化,因此在DNA损伤后,KDM6B KO的细胞能延缓细胞进入G2阻滞。MGMT的上调可以影响但不是唯一调控Chk1的因素,如果使用Chk1抑制剂,也能明显消除KDM6B缺失细胞的耐药性。此外,KDM6B的缺失也会影响细胞内XRCC1的表达,从而影响base-excision repair (BER)通路。
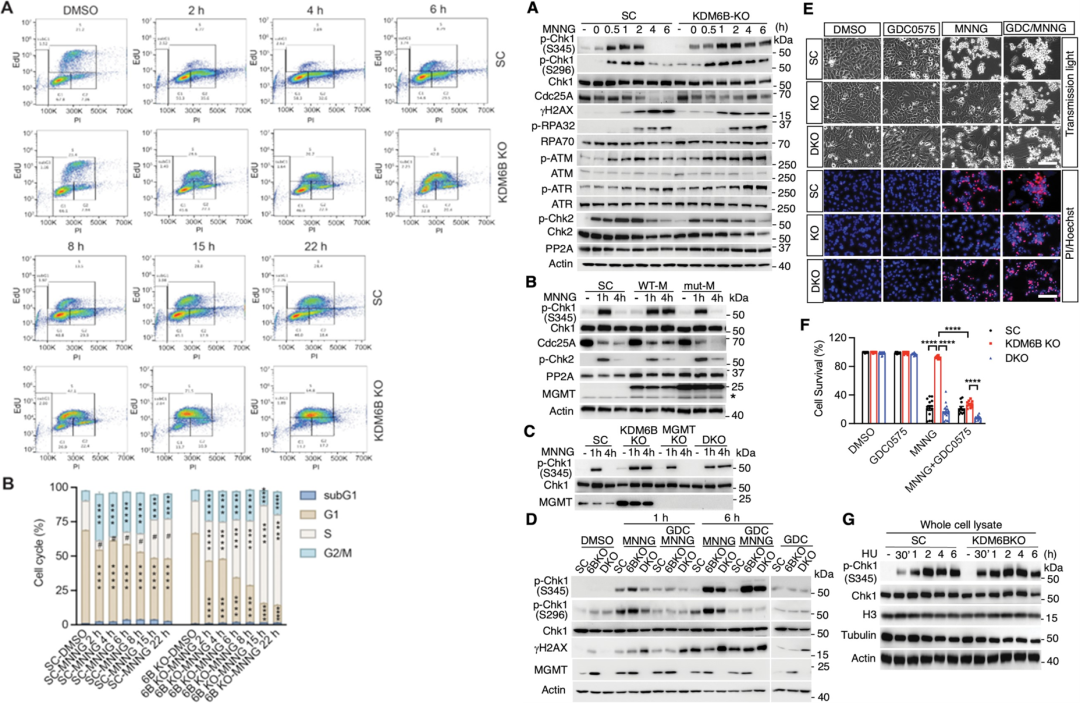
KDM6B影响Chk1,从而影响延缓细胞进入G2期阻滞
关于希格生科
希格生科(Signet Therapeutics)是一家基于疾病模型的癌症创新靶向药研发公司。希格生科成立于2020年底,其最初创立于哈佛大学校园,核心团队由来自哈佛大学、麻省理工学院和中国科学院等学术界以及医药产业界的优秀人才组成。总部设立在深圳,并在美国波士顿设有分部。希格不仅是Signet的音译,而且秉承“希冀满怀,格物致知”的愿景,通过公司团队专业、前沿以及追求极致的努力,让目前无药可用的癌症病人满怀希望,并且致力于通过精准靶向治疗将高致死性的恶性癌症变成可管理的慢性疾病而不懈努力。
